








Guía Resuelta De Química Para El Ingreso A La Universidad
en 3 meses sin intereses de
Lo que tienes que saber de este producto
- Formato: Físico
- Idioma: español.
Características del producto
Características principales
Título | Guía Resuelta de Química Para eI ingreso a la Universidad |
|---|---|
Editorial | Engargolado |
Formato | Físico |
Otros
Idioma | Español |
|---|
Descripción
Guía resuelta de la materia de química para el ingreso a la universidad o estudiar para el examen de finalización de estudios de nivel bachillerato
Tabla de contenido
QUÍMICA ....................................................................................................................................... 9
1. Temas básicos .................................................................................................................... 10
Conceptos básicos ................................................................................................................ 11
Clasificación de la Materia ................................................................................................... 13
Clasificación de la Energía ................................................................................................... 15
2. Sustancias químicas ........................................................................................................... 20
Sustancias puras: Elemento y compuesto. ....................................................................... 20
Mezclas y sus clasificaciones. .............................................................................................. 20
Métodos físicos de separación. .......................................................................................... 21
3. Tabla periódica .................................................................................................................. 27
Clasificación por familias y periodos ................................................................................. 30
Propiedades periódicas ........................................................................................................... 37
4. El átomo ............................................................................................................................... 39
Modelos Atómicos ................................................................................................................. 40
Cálculo de partículas subatómicas. .................................................................................... 49
5. Configuraciones electrónicas .......................................................................................... 51
Orbitales atómicos. ............................................................................................................... 51
Estructura de Lewis. ............................................................................................................... 52
Representación de la estructura de Lewis ........................................................................ 55
Configuración electrónica o configuración periódica. ................................................... 57
6. Clasificación de los compuestos inorgánicos .............................................................. 66
Enlaces Atómicos. .................................................................................................................. 67
Enlaces Intermoleculares. .................................................................................................... 69
Diferencias de electronegatividad ..................................................................................... 72
Clasificación ............................................................................................................................ 73
Nomenclatura ......................................................................................................................... 78
7. Balanceo de ecuaciones químicas ................................................................................. 80
Ley de Lavoisier ...................................................................................................................... 81
Métodos de balanceo de ecuaciones................................................................................ 84
Método por tanteo ........................................................................................................ 84
Método algebraico ........................................................................................................ 86
Método REDOX.............................................................................................................. 89
8. Concepto de Mol ............................................................................................................... 95
Conceptos básicos. ............................................................................................................... 95
1. Molaridad ........................................................................................................................ 96
2. Porcentajes...................................................................................................................... 96
3. Molalidad ........................................................................................................................ 96
4. Normalidad ..................................................................................................................... 96
5. Fracción molar ................................................................................................................ 97
6. Partes por millón ............................................................................................................ 97
Cálculo de masa molar ............................................................................................................. 97
9. Agua ..................................................................................................................................... 99
a. Composición del agua y estructura molecular. ........................................................... 99
b. Propiedades físicas: puntos de ebullición y de fusión. ............................................ 102
a) El amplio margen de temperaturas en que permanece en fase líquida .................. 102
b) La anómala variación de la densidad con la temperatura. .................................. 103
c) Su elevada constante dieléctrica. ............................................................................. 103
d) Su carácter dipolar. ..................................................................................................... 104
e) Su calor específico y calor de vaporización elevados........................................... 104
c. Propiedades químicas del agua. .................................................................................. 105
a) Su gran capacidad de formación de enlaces de hidrógeno ............................... 105
b) Su capacidad de disociación ..................................................................................... 106
10. Ácidos y bases .............................................................................................................. 108
a. Diferenciación de las sustancias de acuerdo con su ph...................................... 109
¿Qué es un ácido? ............................................................................................................... 110
Características de los ácidos ............................................................................................. 110
Tipos de ácidos .................................................................................................................... 110
¿Qué es una base o alcalino? ............................................................................................ 111
Características de las bases ............................................................................................... 111
Tipos de bases ..................................................................................................................... 111
Indicadores de pH ............................................................................................................... 112
¿Qué son los indicadores? ................................................................................................. 112
Clasificación de indicadores .............................................................................................. 113
b. Concepto de soluto y disolvente .................................................................................. 114
c. Concentración: molar y porcentual .............................................................................. 117
b) Contaminación del agua ................................................................................................ 123
c) Importancia y aplicaciones del agua para la humanidad ........................................ 125
Principales usos del agua en la vida del ser humano ................................................... 126
d) Uso responsable y preservación del agua .................................................................. 129
11. Aire ................................................................................................................................. 132
a. Composición del aire ...................................................................................................... 133
b. Reacciones del oxígeno ................................................................................................. 134
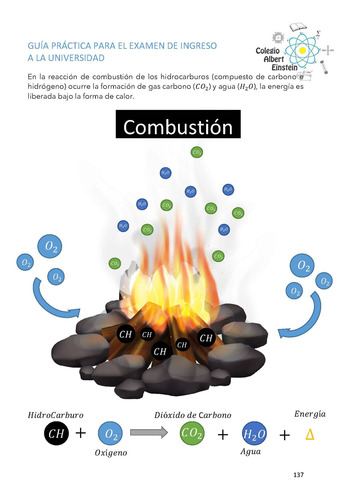
Reacciones de combustión ................................................................................................ 136
Calor de combustión del carbón ...................................................................................... 138
Formación de óxidos .......................................................................................................... 139
c. Ciclos Biogeoquímicos ................................................................................................... 142
Ciclo del carbono ................................................................................................................ 144
Ciclo del oxígeno ................................................................................................................. 145
Ciclo del nitrógeno .............................................................................................................. 146
d. Contaminantes del aire .................................................................................................. 149
Tipos de contaminantes del aire ....................................................................................... 150
Principales fuentes generadoras (industriales, urbanas y agrícolas) ......................... 151
e. Impacto ambiental ........................................................................................................... 153
Inversión térmica. ................................................................................................................. 153
Lluvia ácida. .......................................................................................................................... 154
Efecto invernadero. ............................................................................................................. 154
12. Alimentos ...................................................................................................................... 156
Función y clasificación de las moléculas orgánicas. ..................................................... 157
a. Carbohidratos .................................................................................................................. 158
Fuentes de energía de disponibilidad inmediata ............................................................. 158
Clasificación de los carbohidratos. .................................................................................. 160
Monosacáridos ..................................................................................................................... 160
Oligosacáridos ..................................................................................................................... 162
Disacáridos............................................................................................................................ 163
Polisacáridos ......................................................................................................................... 164
b. Lípidos ............................................................................................................................... 166
Clasificación de los lípidos ................................................................................................. 167
Funciones de los lípidos ..................................................................................................... 167
c. Aminoácidos ..................................................................................................................... 171
d. Grupos funcionales presentes en aminoácidos ......................................................... 172
e. Enlace peptídico .............................................................................................................. 172
f. Proteínas ............................................................................................................................ 174
g. Enzimas .............................................................................................................................. 176
h. Ácidos Nucléicos ............................................................................................................. 177
i. Vitaminas y minerales: fuentes e importancia ............................................................ 178
Las vitaminas ......................................................................................................................... 178
Los minerales. ....................................................................................................................... 182
13. La energía y las reacciones químicas ....................................................................... 188
a. Reacciones químicas endotérmicas y exotérmicas ................................................... 189
Energía química ................................................................................................................... 190
b. Energía interna ................................................................................................................. 191
Primer principio de la Termodinámica. ........................................................................... 193
Variación sin cambio de estado ........................................................................................ 193
Energía cinética media de un gas ideal .......................................................................... 194
Variación con modificación de la composición química .............................................. 196
Variación nuclear ................................................................................................................. 196
c. Entalpía .............................................................................................................................. 198
Significado de entalpía ....................................................................................................... 198
¿Qué relación hay entre Qp y Qv? .................................................................................... 199
Ecuaciones termoquímicas. Diagramas entálpicos....................................................... 199
Entalpía de formación y entalpía de reacción. ............................................................... 200
Entalpía de procesos específicos. .................................................................................... 203
a) Entalpías de combustión. ........................................................................................... 203
b) Entalpías de hidrogenación. ...................................................................................... 203
Ley de Hess. Aditividad de las entalpías de reacción. .................................................. 204
Entalpías de enlace. ............................................................................................................ 205
d. Energía libre y espontaneidad ...................................................................................... 208
Espontaneidad de las reacciones químicas. Concepto de energía de activación.. 208
Segundo principio de la Termodinámica. Concepto de entropía. ............................ 209
Entropía estándar. ............................................................................................................... 212
Entropía estándar de reacción. ......................................................................................... 212
Energía libre de Gibbs. ....................................................................................................... 213
Variación de energía libre de Gibbs y espontaneidad. ................................................ 215
Energía libre de Gibbs estándar de formación. ............................................................. 218
Energía libre estándar de reacción. ................................................................................. 219
Aplicaciones energéticas de las reacciones químicas. ..................................................... 219
Los combustibles. ................................................................................................................ 219
Problemas derivados del uso de los combustibles fósiles. ......................................... 221
Valor energético de los alimentos. ................................................................................... 222
e. Equilibrio químico: Ley de Le Chatelier ...................................................................... 226
Equilibrio Químico............................................................................................................... 226
Principio de Le Chatelier .................................................................................................... 227
Factores que afectan el equilibrio químico .................................................................... 227
f. Velocidad de reacción .................................................................................................... 231
¿Qué factores afectan a la velocidad de reacción? ....................................................... 232
14. Química del carbono .................................................................................................. 236
Propiedades generales de los compuestos orgánicos ................................................ 237
a. Carbono ............................................................................................................................. 238
b. Tipos de enlace carbono-carbono: estructura y modelos ....................................... 239
Representación de las moléculas orgánicas .................................................................. 242
c. Alcanos, Insaturados y Cíclicos ..................................................................................... 248
Propiedades .......................................................................................................................... 249
Nomenclatura ....................................................................................................................... 251
d. Grupos funcionales ......................................................................................................... 252
Grupos funcionales más comunes ....................................................................................... 253
Alcoholes ............................................................................................................................... 254
Éteres ..................................................................................................................................... 256
Ésteres .................................................................................................................................... 257
Aldehídos y Cetonas ........................................................................................................... 258
Ácido carboxílico ................................................................................................................. 261
Aminas ................................................................................................................................... 263
Amidas ................................................................................................................................... 265
Anhídridos ............................................................................................................................. 267
Halógenos ............................................................................................................................. 268
Aminoácidos ......................................................................................................................... 269
Propiedades ............................................................................................................................. 270
e. Isomería estructural ......................................................................................................... 271
Isomería de cadena ............................................................................................................. 272
Isomería de función ............................................................................................................. 272
Isomería de posición ........................................................................................................... 272
Isomería geométrica (cis-trans) ......................................................................................... 273
Isomería óptica ..................................................................................................................... 273
f. Reacciones orgánicas ..................................................................................................... 274
Tipos de reactivos ................................................................................................................ 275
Reacciones de combustión ................................................................................................ 275
Reacciones de sustitución. ................................................................................................. 276
Reacciones de sustitución en anillos aromáticos........................................................... 277
Reacciones de adición ........................................................................................................ 278
Reacciones de eliminación ................................................................................................ 279
Esterificación ......................................................................................................................... 281
Saponificación ...................................................................................................................... 282
Reacciones de oxidación-reducción ................................................................................ 283
Reacciones entre ácidos y bases ...................................................................................... 284
Reacciones de condensación ............................................................................................ 285
Reacciones de hidrólisis ..................................................................................................... 286
g. Reacciones de polimerización por adición y condensación ................................... 287
Polimerización ...................................................................................................................... 287
Polimerización por adición y condensación ................................................................... 287
EXAMEN PRUEBA ........................................................................................................................ 296
Bibliografía .................................................................................................................................... 307
Anexos ........................................................................................................................................... 315
SOLICIONES A LOS EJERCICIOS: ............................................................................................ 322
Respuestas del examen prueba ................................................................................................ 362
Nota:
Esta obra está protegida por el derecho de autor y su reproducción y comunicación pública, en la modalidad de puesta a disposición, se han realizado con autorización de la autora. Queda prohibida su posterior reproducción, distribución, transformación y/o comunicación pública en cualquier medio y de cualquier forma.
Garantía del vendedor: 15 días
Vendido por COLEGIO_ALBERT_EINSTEIN_OAXACA
+5
Ventas concretadas
Brinda buena atención
Entrega sus productos a tiempo
Medios de pago
Preguntas y respuestas
¿Qué quieres saber?
Pregúntale al vendedor
Nadie ha hecho preguntas todavía.
¡Haz la primera!
Publicación #2282485398
DenunciarSe abrirá en una nueva ventana